Kalor, Energi dalam, Kerja dan Hukum Termodinamika I
Oleh : Tri Ayodha Ajiwiguna
Termodinamika klasik membahas tentang energi kalor dan konversinya menjadi kerja. Persamaan energi dalam termodinamika ini diturunkan dari hukum gerak Newton dan definisi kerja yaitu:
Kalor
Kalor merupakan salah satu bentuk energi yang berkaitan dengan temperatur. Kalor juga mengikuti hukum kekealan energi yaitu energi tidak dapat diciptakan atau dimusnahkan tapi dapat dikonversikan ke bentuk energi lain. Dalam termodinamika teknik biasanya membahas tentang perubahan energi kalor menjadi gerak seperti permesinan dengan bahan bakar tertentu. Pada mesin itu terjadi perubahan energi kalor yang berasal dari pembakaran bahan bakar menjadi putaran mesin atau pergerakan piston.
Energi Dalam
Energi dalam pada dasarnya adalah energi kinetik total yang dimiliki molekul zat. Energi dalam sangat tergantung pada temperatur. Untuk gas ideal besarnya energi dalam diturunkan dari konsep ekuipartisi energi sehingga didapat:
Kerja
Kerja didefnisikan sebagai perkalian antara gaya dan perpindahan. Oleh karenanya kerja dapat dituliskan secara matematika sebagai berikut:
Hukum Termodinamika I
Sesuai dengan konsep energi bahwa energi adalah kekal, maka dalam termodinamika juga berlaku hukum ini. Jika ada suatu sistem tertutup kemudian menerima atau melepaskan kalor maka akan terjadi perubahan energi dalam dan terjadi kerja. Hal ini dirumuskan dalam hukum termodinamika I, yaitu:
Tinjauan dalam termodimamika adalah sistem terkait. Jika sistem menerima kalor maka nilai Q bernilai positif sebaliknya jika sistem melepaskan kalor maka Q bernilai negatif. Untuk perubahan energi dalam, nilai ΔU akan bernilai positif jika selam proses mengalami kenaikan suhu begitu pula sebaliknya jika sistem mengalami penurunan suhu maka ΔU bernilai negatif. Kerja W bernilai positif jika sistem melakukan kerja dan negatif jika menerima kerja.
Contoh:
Dalam sebuah sistem piston silinder berisi gas ideal mengalami ekspansi sebesar 30 J. Untuk proses ini memutuhkan kalor sebensar 100 J. Hitunglah berapa perubahan energi dalamnya?




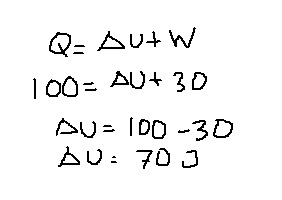


Komentar
Posting Komentar